Научни доказателства за намален риск: Токсикология на системи

Общ преглед
В света има близо 1 милиард пълнолетни пушачи. Пушенето причинява редица сериозни заболявания (в т.ч. сърдечносъдови заболявания, рак на белия дроб и хронична обструктивна белодробна болест (ХОББ)), а тютюневият дим се счита за причинител на близо шест милиона смъртни случаи годишно. Отказът от пушене несъмнено е най-ефективната стратегия пушачите да намалят риска от вредни последствия и заболявания и от много години основните подходи за намаляване на вредата, свързана с цигарите, поставят ударението върху предотвратяване на пропушването и насърчаване на отказа от пушене. Въпреки значителния напредък от 1980 г. насам в намаляването на процента на ежедневно пушене, броят на пушачите стабилно нараства и някои предварителни данни сочат увеличение на процента пушачи сред мъжете.
В този контекст е налице нова възможност за намаляване на вредата от употребата на горими тютюневи изделия, а именно пълнолетните пушачи, които биха продължили да пушат, да преминат на по-малко вредни продукти със значително намалени концентрации на токсични и вредни вещества в сравнение с цигарите. Този подход, известен като намаляване на вредата от тютюна, бързо набира подкрепа сред широк кръг от заинтересовани страни (в т.ч. организации за опазване на общественото здраве, здравни специалисти и регулаторни органи) в много държави (в т.ч. Великобритания, САЩ и Швеция) и допълва действащите стратегии за намаляване на тютюнопушенето.
Пушенето е зависимост от никотина и придобит навик, който се задейства от разнообразни стимули от средата, и пушачите изпитват наслада от ритуалите, свързани с пушенето.
В нашия научноизследователски център 400 учени от световна класа от 30 области на знанието (в т.ч. токсикология, биология на системи и медицина) работят активно за разработването и оценката на негорими никотинови и тютюневи изделия с потенциал за значително намален индивидуален риск в сравнение с цигарите, които да удовлетворят пушачите, като се доближават в най-голяма степен до вкуса, удоволствието и ритуала на пушенето на цигари.
Нашият подход за научна оценка на ПНР е задълбочен, систематичен и включва няколко етапа. Програмата ни за научна оценка (показана на графиката по-долу) се състои от пет стъпки, чиято цел е събиране на пет вида научни данни.
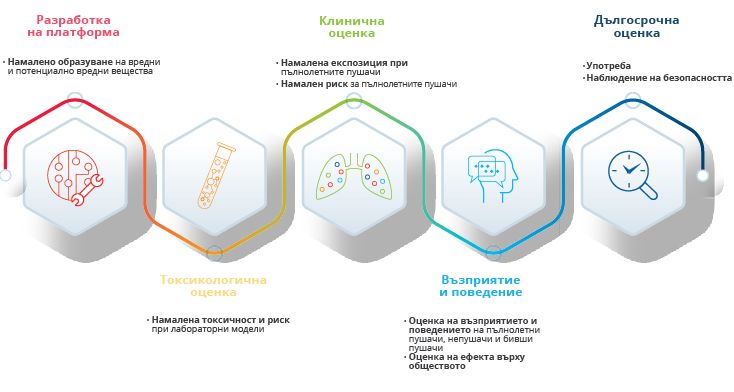
Разработване на платформата
- Намалено образуване на вредни и потенциално вредни вещества
Токсикологична оценка
- Намалена токсичност и риск в лабораторни модели
Клинична оценка
- Намалено излагане при пълнолетни пушачи
- Намален риск при пълнолетни пушачи
Възприемане и поведение
- Оценка на възприемането и поведението при пълнолетни пушачи, непушачи и бивши пушачи
- Моделиране на ефекта за населението
Дългосрочна оценка
- Разпространение
- Наблюдение на безопасността на продуктите
Тези научни данни са от ключово значение, за да се докаже, че новите изделия, съдържащи тютюн и/или никотин, значително намаляват вредата и риска от заболявания, свързани с пушенето за отделните пушачи и имат положителен ефект за здравето на населението като цяло, което се извършва чрез сравнение на резултатите при пушачи и непушачи, и спрямо продължителното пушене.
На етапа на токсикологична оценка се прилага методът на токсикология на системи с основна цел да се определи дали употребата на ПНР намалява риска в лабораторни модели. Вторична цел е да се прецени дали преминаването от излагане на цигарен дим към излагане на аерозол от ПНР води до механистични изменения, които наподобяват тези при спиране на пушене в лабораторни модели. Методът на токсикология на системи се използва и за клинични проби, за да се установят промените, дължащи се на излагане, преди те да се превърнат във видим фенотип (ранно установяване/прогнозиране).
Токсикология на системи и продукти с намален риск
Макар че токсичността на продуктите обикновено се измерва за кратък период от време, техните неблагоприятни ефекти за здравето може да се проявят само след продължително излагане, какъвто е случаят със заболяванията, свързани с пушене. През последното десетилетие стана ясно, че познаването на биологичните механизми в основата на действието на веществата е от ключово значение, за да се обяснят техните токсични ефекти и неблагоприятните събития, които може да причинят.
Излагането на цигарен дим води до молекулярни изменения, които водят до смущения в биологичните механизми, а оттам и до клетъчни/тъканни изменения. Тези промени може да причинят физиологични изменения (например увреждания на органи/тъкани), проява на заболявания и вреда за населението (напр. смъртност). Въздействието на цигарения дим върху тази верига от причинно-следствено обвързани явления може да се определи количествено с помощта на класически и модерни методи на измерване като аналитична химия, цитология, хистопатология, физиологични измервания, „-омика“ технологии (например транскриптомика, протеомика, липидомика и метаболомика) и епидемиология. Тези данни може да се анализират посредством статистически методи и модерни подходи от изчислителната биология. Резултатите от горните изследвания осигуряват задълбочено познаване на ефектите, които излагането на дим причинява и съответно предоставят механистична база за оценка на ПНР.
Токсикологията на системи интегрира токсикология и количествен анализ на големи набори от данни за молекулярни и функционални изменения, възникващи на много нива на биологична организация. Токсикологията на системи дава възможност да се определят биологични мрежи и молекулярни пътеки, които се повлияват от излагането на активни вещества. Това осигурява по-изчерпателно познаване на причинените от излагането молекулярни, клетъчни и тъканни явления и тяхната причинно-следствена връзка с неблагоприятните последствия. Това знание може да се приложи са подробна оценка на риска от продукта за всеки отделен механизъм.
Този подход е особено полезен при съпоставяне на биологичните ефекти от аерозола от ПНР с тези от цигарения дим, тъй като чрез него може да се установи дали намаленото излагане води до намалени смущения във важни биологични процеси, в т.ч. възпаление, клетъчен стрес, клетъчна пролиферация, възстановяване на тъкани и ангиогенеза, и съдба на клетките. Цигареният дим води до смущения в много от тези биологични процеси и има причинно-следствена връзка с развитието на заболявания, свързани с пушенето. Сложните подходи на изчислителната биология позволят количествено определяне на смущенията за всяка биологична мрежа (амплитуди на смущение на мрежата) и могат да бъдат сумирани в общ фактор за относително биологично въздействие (ОФОБВ).
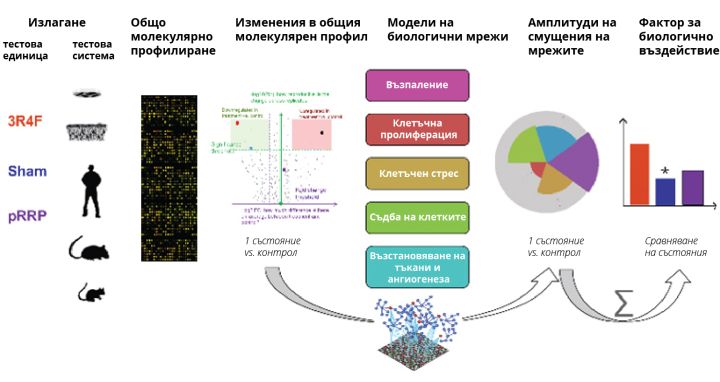
Излагане – тестова единица – тестова система
Общо молекулярно профилиране
Изменения в общия молекулярен профил
Модели на биологични мрежи
- Възпаление
- Клетъчна пролиферация
- Клетъчен стрес
- Съдба на клетките
- Възстановяване на тъкани и ангиогенеза
Амплитуди на смущения на мрежите
Фактор за биологично въздействие
Ние приложихме този подход за широк спектър от in vivo и in vitro изследвания с цел да сравним въздействието на аерозола от СНТ с това при излагане на цигарен дим. В проведеното 8-месечно изследване с мишки in vivo бе наблюдавано намалено въздействие върху патофизиологията, свързана със сърдечносъдови и дихателни заболявания след преминаване от излагане на цигарен дим на излагане на аерозол от СНТ в сравнение с мишки, които са изложени за продължителен период на цигарен дим.
Наскоро публикувахме няколко статии, в които демонстрираме потенциала на новите in vitro-базирани процедури за изпитване за реализиране на визията за токсикология от 21ви век. Бе установено по-ниско въздействие при повтарящо се излагане на аерозола от СНТ върху човешки гингивални тъкани в сравнение с това от цигарен дим. Неотдавна осъщественият мета-анализ, който включва функционални измервания (цитотоксичност, функционалност на цилиарните клетки, и профили на провъзпалителни медиатори) и модерни изчислителни подходи за анализ на набори от гени и причинно-следствено обогатяване на мрежите доведе до обстойна оценка на биологичното въздействие при остро излагане на аерозол от СНТ в сравнение с цигарен дим върху in vitro човешки органотипични устни, бронхиални и назални култури.
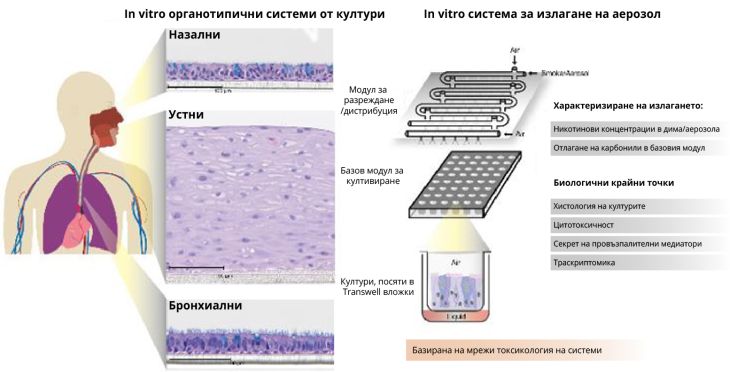
In vitro органотипични системи от култури
- Назални
- Устни
- Бронхиални
In vitro система за излагане на аерозол
- Модул за разреждане/дистрибуция
- Базов модул за култивиране
- Култури, посяти в Transwell вложки
Характеризиране на излагането:
Никотинови концентрации в дима/аерозола
Отлагане на карбонили в базовия модул
Биологични крайни точки
Хистология на културите
Цитотоксичност
Секрет на провъзпалителни медиатори
Траскриптомика
Базирана на мрежи токсикология на системи
*Продукти с намален риск (ПНР) е термин, с който обозначаваме продуктите, които представляват, биха могли да представляват или имат потенциала да представляват намален риск за пушачите, които преминат на тях в сравнение с продължителното пушене. Ние разполагаме с широка гама от ПНР на различен стадий на развитие, научна оценка и търговска реализация. Тъй като при нашите ПНР тютюнът не гори, те образуват много по-ниски количества вредни и потенциално вредни вещества в сравнение с цигарения дим.
Публикацията е спонсорирана от Филип Морис България
Източници
1. World Health Organization. WHO Report on the global tobacco epidemic, 2015. Available online @ http://www.who.int/tobacco/global_report/2015/report/en/
2. Ng et al. Smoking prevalence and cigarette consumption in 187 countries, 1980-2012. JAMA. 2014; 311: 183–192
3. Royal College of Physicians (2016) Nicotine without smoke: Tobacco harm reduction. London: RCP
4. Fagerström KO and Eissenberg T (2012) Dependence on tobacco and nicotine products: a case for product-specific assessment. Nicotine Tob. Res. 14:1382-1390.
5. Smith et al. (2016) Evaluation of the Tobacco Heating System 2.2. Part 1: Description of the system and the scientific assessment program. Regul. Toxicol. Pharmacol. 81 Suppl 2:S17-S26.
6. Sturla et al. (2014) Systems Toxicology: from basic research to risk assessment. Chem. Res. Toxicol. 27:314-329, in press. (@PMI Science) (PMID: 24446777) (doi: 10.1021/tx400410s)
7. Hoeng et al. (2014) Toxicopanomics: applications of genomics, transcriptomics, proteomics and lipidomics in predictive mechanistic toxicology. In: Hayes' Principles and Methods of Toxicology, Sixth Edition. Oct 2014 , 295 -332. (doi: 10.1201/b17359-9)
8. Boue, et al. (2015). Causal biological network database: a comprehensive platform of causal biological network models focused on the pulmonary and vascular systems. Database 2015: bav030. (@PMI Science) (PMID: 25887162) - doi:10.1093/database/ba
9. Martin et al. (2014). Quantification of biological network perturbations for mechanistic insight and diagnostics using two-layer causal models. BMC Bioinformatics 15: 238. (@PMI Science) (PMID: 25015298) - doi:10.1186/1471-2105-15-238
10. Zanetti et al. (2017). Comparative systems toxicology analysis of cigarette smoke and aerosol from a candidate modified risk tobacco product in organotypic human gingival epithelial cultures: A 3-day repeated exposure study. Food Chem Toxicol 29(8): 1252-1269. (@PMI Science) (PMID: 28025120) - doi:10.1016/j.fct.2016.12.027
11. Thomson et al. (2013) Quantitative assessment of biological impact using transcriptomic data and mechanistic network models. Toxicol. Appl. Pharmacol. 272(3):863–78, (@PMI Science) (PMID: 23933166) (doi:10.1016/j.taap.2013.07.007)
12. Phillips et al. (2016). An 8-month systems toxicology inhalation/cessation study in Apoe-/- mice to investigate cardiovascular and respiratory exposure effects of a candidate modified risk tobacco product, THS 2.2, compared with conventional cigarettes. Toxicol Sci 149(2): 411-432. (@PMI Science) (PMID: 26609137) – (doi:10.1093/toxsci/kfv243)
13. Iskandar et al. (2017). Systems toxicology meta-analysis of in vitro assessment studies: biological impact of a candidate modified-risk tobacco product aerosol compared with cigarette smoke on human organotypic cultures of the aerodigestive tract. Toxicol Res, in press. (@PMI Science) - doi:10.1039/C7TX00047B



Коментари по темата